Оптимизация техники витрэктомии при поздних стадиях пролиферативной диабетической ретинопатии
Покупка
Основная коллекция
Тематика:
Эндокринология и болезни обмена веществ
Издательство:
Эндокринологический научный центр
Год издания: 2008
Кол-во страниц: 2
Дополнительно
Скопировать запись
Фрагмент текстового слоя документа размещен для индексирующих роботов
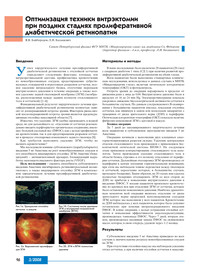
Оптимизация техники витрэктомии при поздних стадиях пролиферативной диабетической ретинопатии Я.В. Байбородов, Л.И. Балашевич Санкт-Петербургский филиал ФГУ МНТК «Микрохирургия глаза» им. академика Св. Федорова (директор филиала – д.м.н., профессор Л.И. Балашевич) 3/2008 16 Введение У У спех хирургического лечения пролиферативной диабетической ретинопатии с отслойкой сетчатки определяют следующие факторы: площадь зон витреоретинальной адгезии, профилактика кровотечения из новообразованных сосудов, предотвращение субретинальных геморрагий и ятрогенных разрывов сетчатки, полное удаление витреального базиса, отсутствие перепадов внутриглазного давления в течение операции, а также полное удаление задней гиалоидной мембраны (ЗГМ) (мембрана, расположенная между задним полюсом стекловидного тела и сетчаткой) [1–6]. Функциональный результат хирургического лечения пролиферативной диабетической ретинопатии полностью зависит от дооперационной остроты зрения. Фактором риска низкой послеоперационной остроты зрения является предоперационная отслойка макулярной области [7]. Известно, что удаление ЗГМ удобно производить в водной среде, но для дальнейшего ее отделения от сетчатки рекомендовано вводить перфтористое органическое соединение, имеющее большой удельный вес (ПФОС), как с целью профилактики кровотечения, так и для предотвращения разрывов сетчатки в процессе отсепаровки измененного заднего гиалоида [8]. Как требуется выполнить удаление ЗГМ, чтобы не вызвать кровотечение? Мы исследовали влияние субтенонового (парабульбарного) введения 5 мг Авастина на рост новообразованных сосудов и его способность индуцировать отслойку ЗГМ. Авастин (бевацизумаб) – антиангиогенный препарат, блокирующий выработку вазоэндотелиального фактора роста (VEGF). Цель исследования – оценить способность субтенонового введения Авастина ингибировать ретиновитреальный неоангиогенез, а также индуцировать отслойку ЗГМ в комплексном хирургическом лечении пролиферативной диабетичес кой ретинопатии. Материалы и методы В наше исследование было включено 20 пациентов (28 глаз) с сахарным диабетом 1 типа (СД 1) при наличии развитой пролиферативной диабетической ретинопатии на обоих глазах. Всем пациентам были выполнены стандартные клинические исследования, используемые в данных случаях в МНТК «Микрохирургия глаза», включая оптическую когерентную томографию (ОКТ) и фотоконтроль. Острота зрения до операции варьировала в пределах от движения руки у лица до 0,04. Внутриглазное давление было в пределах от 16 до 24 mm Hg. Электроретинограмма показала умеренное снижение биоэлектрической активности сетчатки в большинстве случаев. По данным ультразвукового В-сканирования у большинства пациентов имелась локальная отслойка сетчатки, как минимум в одном или нескольких квадрантах с тракциями от диска зрительного нерва (ДЗН) к периферии. Оптическая когерентная томография (ОКТ) показала наличие фиброзно-измененной ЗГМ с адгезией в макуле. Техника операции За 7 дней до запланированного хиургического лечения всем пациентам в субтеноновое пространство вводили 5 мг Авастина. Операцию начинали с выполнения двух клапанных самогерметизирующихся разрезов склеры. Удаление центральных отделов стекловидного тела производили с применением бесконтактной оптической системы BIOM-3. На следующем этапе применяли контрастирование стекловидного тела кеналогом. Затем производили удаление стекловидного тела в области базиса, стремясь к его полному отделению от периферии сетчатки. Дальнейшая отсепаровка ЗГМ производилась от периферии к центру плоскими горизонтальными ножницами, при этом мы наблюдали тонкие перемычки между гиалоидом и сетчаткой, пересечение которых, в большинстве случаев, проходило бескровно. Таким образом, на 20 глазах нам удалось полностью бескровно отсепаровать ЗГМ со всех сторон до ДЗН, не прибегая к повышению внутриглазного давления и введению ПФОС. У восьми пациентов произошло кровотечение из крупных вен при отделении ЗГМ от сетчатки, которое было остановлено повышением давления. Наиболее драматичным моментом всей операции являлось отделение от диска зрительного нерва проросшей неполноценными сосудами ЗГМ, которое мы выполнили у всех пациентов. Кровотечение из ДЗН наблюдалось у всех пациентов, которое было успешно остановлено при помощи интраоперационного введения ПФОС. В конце операции, с целью устранения отслойки сетчатки и повышения эффективности эндолазеркоагуляции, производилась тампонада ПФОС. Через 7 дней, вторым этапом, производилась пассивная замена ПФОС на силиконовое масло, которое, в свою очередь, удаляли через 1–2 месяца. Результаты Субтеноновое введение 5 мг Авастина приводило во всех случаях к значительному регрессу новообразованных сосудов на ЗГМ. При отсутствии отслойки макулы мы наблюдали усиление отека сетчатки, а при наличии отслойки сетчатки в макуляр Рис.1а. Тракционая отслойка сетчатки в макуле Рис. 2а. Выраженная проли фера ция ЗГМ Рис 2б. ЗГМ и ВПМ полностью удалены Рис.1б. Состояние после удаления ЗГМ и внутренней пограничной мембраны (ВПМ)